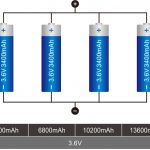
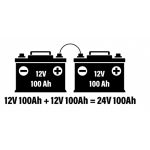
Turvallisuus on täysimittainen ominaisuus litiumparistoilla, ja hyvästä syystä. Kuten olemme kaikki nähneet, kemia ja energian tiheys, jotka antavat litiumioniakkujen toimia niin hyvin, tekevät niistä myös syttyviä, joten kun paristot eivät toimi oikein, ne aiheuttavat usein upean ja vaarallisen sotkun. Kaikkia litiumkemiaa ei luoda tasa-arvoisesti. Itse asiassa useimmat amerikkalaiset kuluttajat - lukuun ottamatta sähköisiä harrastajia - tuntevat vain rajoitetun määrän litiumratkaisuja. Yleisimmät versiot on rakennettu kobolttioksidi-, mangaanioksidi- ja nikkelioksidiformulaatioista. Ensinnäkin, otetaan askel ajassa taaksepäin. Litiumioniakut ovat paljon uudempi innovaatio, ja niitä on ollut käytössä vain viimeiset 25 vuotta. Tänä aikana litiumtekniikoiden suosio on kasvanut, koska ne ovat osoittautuneet arvokkaiksi pienempien elektroniikkojen - kuten kannettavien tietokoneiden ja matkapuhelinten - virransaannissa. Mutta kuten muistat viime vuosien lukuisista uutisista, litium-ioniakut saivat myös maineen tulen sytyttämisestä. Viime vuosiin asti tämä oli yksi tärkeimmistä syistä, miksi litiumia ei yleisesti käytetty suurten akkupankkien luomiseen. Mutta sitten tuli litium-rautafosfaatti (LiFePO4). Tämä uudentyyppinen litiumliuos oli luonnostaan palamaton, mutta mahdollisti hieman pienemmän energiatiheyden. LiFePO4-paristot eivät ole vain turvallisempia, vaan niillä on monia etuja muihin litiumkemikaaleihin verrattuna, erityisesti suuritehoisissa sovelluksissa, kuten uusiutuvassa energiassa. Ennen kuin sukellamme litium rautafosfaatin turvaominaisuuksiin, päivitetään itsemme siitä, miten litiumparistojen toimintahäiriöt tapahtuvat ensinnäkin. Litiumioniakut räjähtävät, kun akun täysi lataus vapautuu välittömästi tai kun nestemäiset kemikaalit sekoittuvat vieraisiin epäpuhtauksiin ja syttyvät. Tämä tapahtuu tyypillisesti kolmella tavalla: fyysinen vaurio, ylikuormitus tai elektrolyytin hajoaminen. Esimerkiksi, jos sisäinen erotin tai latauspiiri on vahingoittunut tai siinä on toimintahäiriöitä, ei ...
Lue lisää…










![]() 100% turvallinen maksu
100% turvallinen maksu![]()
